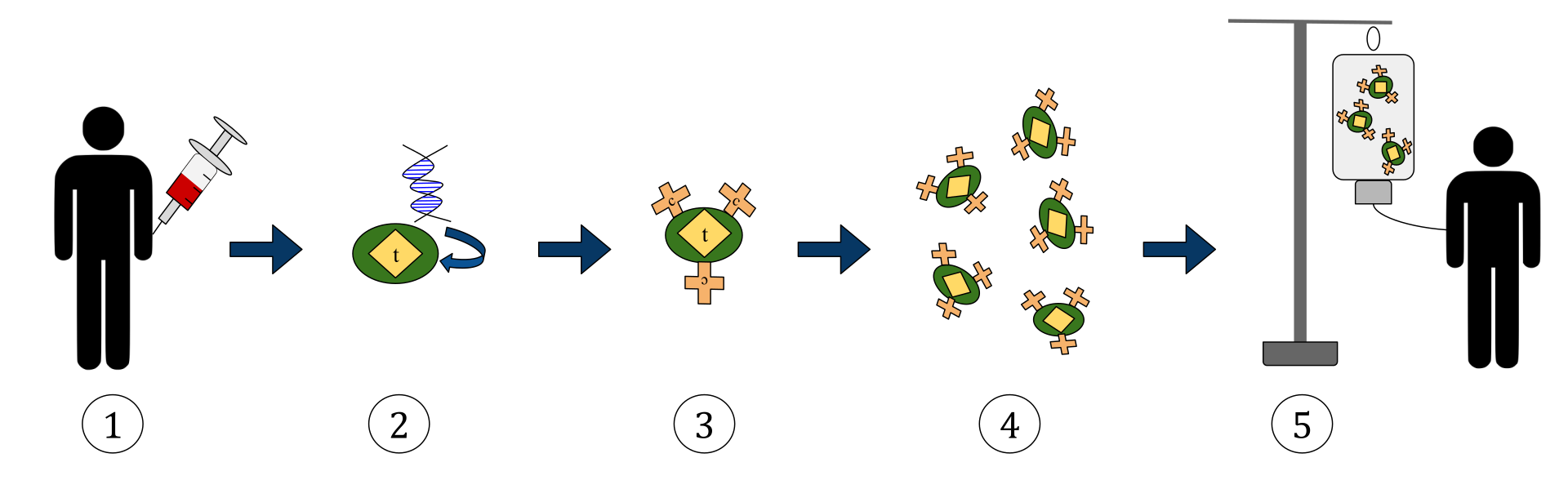
Наведена вище схема представляє процес химерної терапії Т-клітинними рецепторами антигену (CAR). Це метод імунотерапії, який стає все більшою практикою лікування раку. Кінцевим результатом має стати вироблення оснащених Т-клітин, які можуть розпізнавати та боротися із зараженими раковими клітинами в організмі.
1. Т-клітини (представлені предметами, позначеними як “t”) видаляються з крові пацієнта.
2. Потім в лабораторії ген, який кодує специфічні рецептори антигену, включається в Т-клітини.
3. Таким чином продукуючи рецептори CAR (позначені як c) на поверхні клітин.
4. Нові модифіковані Т-клітини потім збирають і вирощують у лабораторії.
5. Через певний проміжок часу сконструйовані Т-клітини вводяться назад у пацієнта.
Химерні Т-клітини рецептора антигену (також відомий як CAR Т-клітини) – це Т-клітини, розроблені генетично для створення штучного рецептора Т-клітин для використання в імунотерапії.
Химерні рецептори антигену (АВТОМОБІЛІ, також відомий як химерні імунорецептори, химерні рецептори Т-клітин, або штучні рецептори Т-клітин) – це рецепторні білки, розроблені для надання Т-клітинам нової здатності орієнтуватись на певний білок. Рецептори є химерними, оскільки вони поєднують як антигензв’язуючі, так і активізуючі Т-клітини функції, в єдиний рецептор.
Клітинна терапія CAR-T використовує Т-клітини, розроблені з CARs для терапії раку. Передумовою імунотерапії CAR-T є модифікація Т-клітин для розпізнавання ракових клітин з метою ефективнішого націлювання та знищення їх. Вчені збирають у людей Т-клітини, генетично їх змінюють, а потім вливають отримані CAR-T-клітини пацієнтам, щоб атакувати їх пухлини. Клітини CAR-T можуть бути отримані з Т-клітин у власній крові пацієнта (аутологічні) або отримані з Т-клітин іншого здорового донора (алогенні). Після ізоляції від людини ці Т-клітини генетично сконструйовані для експресії специфічного CAR, який програмує їх для націлювання на антиген, який присутній на поверхні пухлин. З міркувань безпеки клітини CAR-T спроектовані таким чином, щоб бути специфічними до антигену, експресованого на пухлині, який не експресується на здорових клітинах.
Після того, як клітини CAR-T вводяться пацієнту, вони діють як «живий препарат» проти ракових клітин. Коли вони контактують зі своїм цільовим антигеном на клітині, клітини CAR-T зв’язуються з нею і активізуються, а потім продовжують розмножуватися і стають цитотоксичними. Клітини CAR-T руйнують клітини за допомогою декількох механізмів, включаючи велику стимульовану проліферацію клітин, збільшуючи ступінь їх токсичності для інших живих клітин (цитотоксичність) та викликаючи посилену секрецію факторів, які можуть впливати на інші клітини, такі як цитокіни, інтерлейкіни та фактори росту.
Виробництво клітин CAR-T

Першим кроком у виробництві CAR-T-клітин є виділення Т-клітин з крові людини. Клітини CAR-T можуть бути виготовлені або з власної крові пацієнта, відомого як аутологічне лікування, або з крові здорового донора, відомого як алогенне лікування. Процес виготовлення в обох випадках однаковий; лише вибір початкового донора крові різний.
По-перше, лейкоцити виділяють за допомогою сепаратора клітин крові в процесі, відомому як аферез лейкоцитів. Потім одноядерні клітини периферичної крові (PBMC) відокремлюють і збирають. Потім продукти аферезу лейкоцитів передаються в центр обробки клітин. У центрі обробки клітин стимулюються специфічні Т-клітини, щоб вони активно розмножувались і розширювались до великої кількості. Щоб стимулювати їх експансію, Т-клітини зазвичай обробляють цитокіном інтерлейкіном 2 (IL-2) та анти-CD3 антитілами.
Розширені Т-клітини очищають, а потім трансдукують геном, що кодує сконструйований CAR через ретровірусний вектор, як правило, або інтегруючий гаммаретровірус (RV), або лентивірусний (LV) вектор. Ці вектори дуже безпечні в наш час через часткове видалення області U3. Новий засіб редагування генів CRISPR / Cas9 нещодавно використовувався замість ретровірусних векторів для інтеграції гена CAR у конкретні ділянки геному.
Пацієнт проходить хіміотерапію з виснаженням лімфи до впровадження сконструйованих клітин CAR-T. Зниження кількості циркулюючих лейкоцитів у пацієнта підвищує кількість цитокінів, що виробляються, і зменшує конкуренцію за ресурси, що сприяє розширенню сконструйованих клітин CAR-T.
Клінічні програми
Станом на березень 2019 року було проведено близько 364 клінічних випробувань, що проводились у всьому світі за участю клітин CAR-T. Більшість з цих досліджень націлені на рак крові: терапія CAR-T становить більше половини всіх досліджень щодо гематологічних злоякісних пухлин. CD19 продовжує залишатися найпопулярнішою мішенню антигену, за якою слідує BCMA (зазвичай виражається в множинній мієломі). У 2016 році дослідження почали досліджувати життєздатність інших антигенів, таких як CD20. У випробуваннях на солідні пухлини менше домінує CAR-T, де близько половини випробувань на основі клітинної терапії залучають інші платформи, такі як NK-клітини.
Рак
Т-клітини генетично сконструйовані для експресії химерних антигенних рецепторів, спеціально спрямованих до антигенів на пухлинних клітинах пацієнта, а потім вводяться пацієнту там, де вони атакують і вбивають ракові клітини. CAR-модифіковані Т-клітини можуть бути розроблені для націлювання практично на будь-який асоційований з пухлиною антиген.
Ранні дослідження клітин CAR-T були зосереджені на раку крові. Перші схвалені методи лікування використовують CAR, спрямовані на антиген CD19, присутній у раках, отриманих з В-клітин, таких як гострий лімфобластний лейкоз (ALL) та дифузна велика B-клітинна лімфома (DLBCL). Зустрічі також проводяться з метою розробки ЦАР, націлених на багато інших антигенів раку крові, включаючи CD30 у рефрактерній лімфомі Ходжкіна; CD33, CD123 та FLT3 при гострому мієлоїдному лейкозі (AML); і BCMA при множинній мієломі.
Солідні пухлини мають більш складну мішень. Ідентифікація хороших антигенів була складною: такі антигени повинні бути сильно виражені на більшості ракових клітин, але в основному відсутні в нормальних тканинах. Клітини CAR-T також не потрапляють ефективно в центр масивів твердих пухлин, а вороже мікросередовище пухлини пригнічує активність Т-клітин.
Аутоімунне захворювання
Хоча більшість досліджень Т-клітин CAR зосереджені на створенні Т-клітини CAR, яка може викорінити певну популяцію клітин (наприклад, CAR-Т-клітини, націлені на клітини лімфоми), існує й інше можливе використання цієї технології. Т-клітини також можуть захищати власні антигени від аутоімунних реакцій. Регуляторна Т-клітина, оснащена CAR, може мати потенціал для надання толерантності до певного антигену, що може бути використано при трансплантації органів або ревматичних захворюваннях, таких як вовчак.
Satefy
Існують серйозні побічні ефекти, які виникають в результаті введення в організм клітин CAR-T, включаючи синдром вивільнення цитокінів та неврологічну токсичність. Оскільки це відносно нове лікування, існує мало даних про довгострокові наслідки терапії клітинами CAR-T. Як і раніше існують занепокоєння щодо довготривалого виживання пацієнта, а також ускладнень вагітності у пацієнток, які отримували клітини CAR-T. Анафілаксія є очікуваним побічним ефектом, оскільки CAR проводиться з чужорідним моноклональним антитілом і, як наслідок, провокує імунну відповідь.
Розпізнавання на цілі / поза пухлиною відбувається, коли клітина CAR-T розпізнає правильний антиген, але антиген експресується на здоровій непатогенній тканині. Це призводить до того, що клітини CAR-T атакують непухлинні тканини, такі як здорові В-клітини, які експресують CD19. Ступінь вираженості цього побічного ефекту може варіюватися від аплазії В-клітин, яку можна лікувати допоміжними інфузіями, до крайньої токсичності, що призводить до смерті.
Існує також малоймовірна ймовірність того, що сконструйовані CAR-T-клітини самі перетворяться в ракові клітини за допомогою інсерційного мутагенезу завдяки вірусному вектору, що вводить ген CAR в супресор пухлини або онкоген у геномі Т-клітини-господаря. Деякі ретровірусні (RV) вектори мають менший ризик, ніж лентивірусні (LV) вектори. Однак обидва вони можуть бути онкогенними. Для кращого розуміння функції та стійкості Т-клітин CAR in vivo встановлено геномний аналіз послідовності місць вставки CAR у Т-клітинах.
Синдром вивільнення цитокінів
Найбільш поширеною проблемою після лікування клітинами CAR-T є синдром вивільнення цитокінів (CRS), стан, при якому імунна система активується і вивільняє підвищену кількість запальних цитокінів. Клінічний прояв цього синдрому нагадує сепсис з високою температурою, втомою, міалгією, нудотою, витіканням капілярів, тахікардією та іншими порушеннями функції серця, печінковою недостатністю та порушеннями роботи нирок. CRS зустрічається майже у всіх пацієнтів, які отримують терапію CAR-T-клітинами; насправді, наявність CRS є діагностичним маркером, який вказує на те, що клітини CAR-T працюють так, як призначено для знищення ракових клітин. Однак зауважте, що вищий ступінь тяжкості CRS не корелює з підвищеною реакцією на лікування, а навпаки, більшим тягарем захворювання.
Нейротоксичність імунної ефекторної клітини
Неврологічна токсичність також часто асоціюється з лікуванням клітин CAR-T. Механізм, що лежить в основі, недостатньо зрозумілий і може бути пов’язаний з CRS, а може і не бути. Клінічні прояви включають марення, часткову втрату здатності когерентно говорити, маючи при цьому здатність інтерпретувати мову (виразна афазія), знижену настороженість (обтупаність) та судоми. В ході деяких клінічних випробувань мали місце смерті, спричинені нейротоксичністю. Основною причиною смерті від нейротоксичності є набряк мозку. У дослідженні, проведеному компанією Juno Therapeutics, Inc., п’ять пацієнтів, які брали участь у дослідженні, померли в результаті набряку мозку. Двох пацієнтів лікували лише циклофосфамідом, а решту трьох – комбінацією циклофосфаміду та флударабіну. В іншому клінічному дослідженні, спонсорованому Центром досліджень раку імені Фреда Хатчінсона, був зареєстрований один випадок незворотної та летальної неврологічної токсичності через 122 дні після введення клітин CAR-T.
.














Discussion about this post